
这就是六水合铁离子的颜色,非常漂亮
或许是因为氯化铁硫酸铁等含铁离子的化合物的颜色都是黄色或棕黄色,以至于很多学生都认为铁离子的颜色是黄色,但只要学过无机化学过渡元素部分的人都知道,这是错误的。
理论分析(大部分为直接引用)我们所说的铁离子通常是六水合铁离子的简称。配位体与中心离子的电子之间互相排斥,由此形成一个静电场。在这个静电场中,由于坐标取向的原因,中心离子的s、p轨道虽然能级上升但依然简并,d轨道则发生能级分裂。分裂后的d轨道之间存在能级差(即分裂能),如果此时所有的d轨道不是全满或全空,在这些d轨道之间就会存在d-d电子跃迁,此跃迁会吸收可见光中的某些单色光,从而放出颜色环中该单色光所相应的互补色。当然,除了d-d跃迁外,还有f-f跃迁、电荷迁移跃迁等导致的颜色现象。
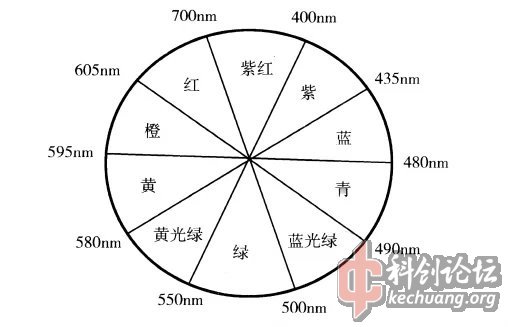
Fe3+ 本身是没有可见光吸收的,例如Fe2(SO4)3固体呈现的就是白色硫酸根离子基本上不与Fe3+ 形成配位离子,所以其d轨道没有能级分裂,不会因d-d跃迁而吸收可见光)。因此,对于[Fe(H2O)6]3+,其配体H2O分子对Fe3+所造成的d轨道能级分裂并进而发生d-d跃迁是其具有浅紫色的关键原因。由于其六配位给出的是个八面体场,其价层d轨道将分裂为图中的两组轨道。
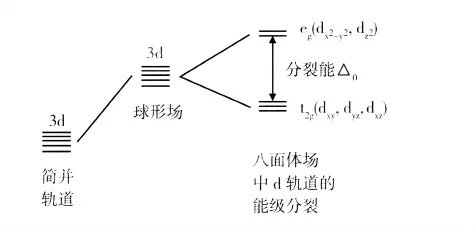
由于H2O 为弱配体,d轨道的分裂能较小,[Fe(H2O)6]3+ 中Δ0=13700cm-1 (约2.72×10^-19J),其电子成对能(约5.93×10^-19J)明显高于分裂能,所[Fe3+的5个d电子选择了高自旋状态,实验测得其磁矩μ=5.8B.M.,这证实确有5个单电子.
上述结果显示:由于eg轨道上有单电子,t2g的电子可以发生d-d跃迁。根据其分裂能值,其d-d跃迁时吸收光的波长似乎应该在730nm附近。然而,D.D.COX等人的研究表明:由于Fe3+具有较强的吸引电子能力,配体H2O中氧原子的孤对电子与Fe3+ 之间存在分子内配体到中心离子的电荷转移跃迁(LMCT),这种荷移跃迁所需吸收的能量大致在5000cm-1,它会导致中心离子的吸收峰显著蓝移。按此标准来估算,[Fe(H2O)6]3+真正的吸收峰应该在530nm 附近。本文的实测结果在512nm,按图1中颜色环的互补色原理,[Fe(H2O)6]3+ 吸收的是绿光,所以它放出来的应该是紫红色光。不过,由于Fe3+ 的d轨道属于半满状态,其d-d跃迁在自旋上是禁阻的,所以其跃迁的几率较小,这导致其紫色非常淡(浅紫色)。
然而事实上我们所见到的Fe3+水溶液均为黄色或棕黄色,这主要是由Fe3+的水解造成的。
Fe3+由于具有较大的电荷半径比,所以Fe3+有较高的正电场,这就导致其在水溶液中易发生水解。其水解原理部分描述如下:
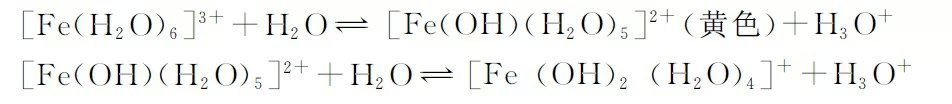
除了水解,同时还有一些缩合反应伴随发生,得到一些二聚体产物。例如:
![4.jpg]()
实际的水解产物有很多种,其中主要为羟基水合铁离子的形式,这类离子的吸收峰在紫外区,但其尾部进入了可见光的短波区,按图1颜色环的互补原理,它们呈现出黄色。
但是氯化铁有些特殊,铁离子会和氯离子形成配合物,并呈现颜色(类似和铜离子的配合物)
实验虽说教材说pH值小于1就可观察到紫色,但实际水一多即为黄色(屡次实验均是这个结果)
本次实验按照文章提供方法进行,即向浓硫酸(为尽可能减少水解)中加入亚铁离子,利用浓硫酸氧化性氧化为铁离子(因为市售硫酸铁中铁离子通常都已经水合和水解)
新制硫酸亚铁
![5.jpg]()
向试管中加入浓硫酸
![6.jpg]()
向试管中滴入少许硫酸亚铁溶液,并不断振荡,即可见非常明显的颜色
![7.jpg]()
友情提示:高浓度硫酸亚铁溶液加多了颜色会非常深
 六水合铁离子呈现浅紫色的理论分析和实验验证.attach
434.47KB
PDF
1464次下载
预览
六水合铁离子呈现浅紫色的理论分析和实验验证.attach
434.47KB
PDF
1464次下载
预览



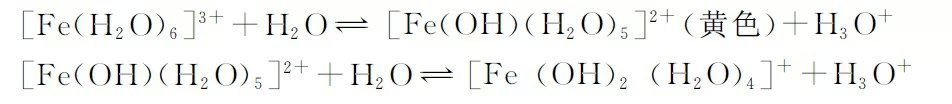




200字以内,仅用于支线交流,主线讨论请采用回复功能。