本帖最后由 火星居士 于 2014-2-16 23:12 编辑 一、绪论
论坛上关于燃料电池的文章不少,但是真正将燃料电池制作过程发到网上的并不多。因此该帖旨在完整实践普通氢氧燃料电池的制作使用过程,验证理论和工艺的正确性。
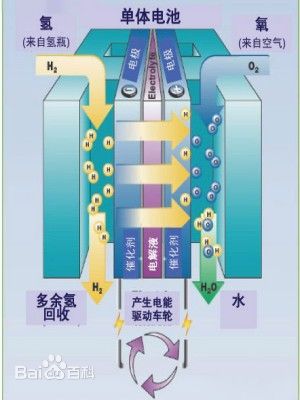
简要介绍一下原理
氢氧燃料电池工作时向负极供给燃料(氢),向正极供给氧化剂(空气,起作用的成分为氧气)。氢在负极分解成正离子H+和电子e-。当氢离子进入电解液中,而电子就沿外部电路移向正极。用电的负载就接在外部电路中。在正极上,空气中的氧同电解液中的氢离子吸收抵达正极上的电子形成水。这正是水的电解反应的逆过程。
氢氧燃料电池按电池结构和工作方式分为离子膜、培根型和石棉膜三类。笔者制作的是碱性氢氧燃料电池,俗称“培根电池”,是最早发明并投入使用的燃料电池之一。美国阿波罗飞船和航天飞机两台航天机都使用这种燃料电池。这种电池效率较高,但需要比较多的液体电解质和笨重的反应容器,因此整个电池质量比较大,启动停止时间长。
由于电解质是碱性溶液(氢氧化钾),因此氢气失电子生成的氢离子回立即与电解液中的氢氧根离子反应生成水。放电方程式分别为
负极:2H2 + 4OHˉ-4eˉ== 4H2O
正极:O2 + 2H2O + 4eˉ== 4OHˉ
总反应:2H2+O2==2H2O
氢氧燃料电池为了获取比较高的催化效率,一般会使用多孔石墨电极或者是铂,镍电极,兼具催化剂的作用。
目前网上制作的燃料电池主要有两种,一种是再生式,先通过电解电解质溶液产生氢气氧气进行充电,再利用电解出的气体进行放电。另外一种是直接通气式(简称通气式),即直接向电池中通入氢气和氧气,进行放电反应。
充电时的反应与电解水相同,正极产生氧气,负极产生氢气。方程式分别为
负极:2H++2e-=H2↑
正极:4OH- - 4e-=2H2O+O2↑
总反应:2H2O=(通电)2H2↑+O2↑
在选择电池的类型上,笔者也曾经犹豫过。再生式简单易行,但并不能算上真正意义的实用的燃料电池(最多算是可充电电池),而通气式燃料电池又需要两套气体发生装置和导气,密封装置,对系统提出了比较高的要求。犹豫再三后,笔者决定,设计一款兼容两种模式(即再生模式和通气模式)的电池。本文将重点介绍燃料电池各个部件的制作和再生模式下燃料电池的表现。
二、电池的制作
燃料电池主要分为反应容器,电极和导气装置。本章将逐一介绍这些零件的制作过程
1. 反应容器的制作
由于要兼容两种模式,因此要求电极一段密封,而且还能导气。因此笔者选择了一只三口烧瓶,容积为100ml,口部最大内径为19mm.两端的两口插入电极并密封,中间的口插入导气管,气体从中间导入,输到电极处(如图所示)。在再生模式下运行时,直接从两端的电极处产生氢气并留存。
![163817mso4t9zsvomm4wv3.jpg]()
2. 电极的制作
由于买不起昂贵的工业铂电极,因此笔者使用了复合电极方案——自制多孔石墨电极+铂丝缠绕,双保险保证电池有足够的反应效率。
制作多孔石墨电极需要对石墨电极进行热处理。由于家中已无酒精,热处理依然是在厨房的煤气灶上进行。将石墨电极在火焰中灼烧2-3分钟后,立即放入冷水中淬火,将表面擦干后继续加热,如是重复4-5次,即可得到多孔石墨电极
![163823govqkdpeekykoyx2.jpg]()
加热石墨电极
![163926laibxdi1kdskwxkm.jpg]()
淬火
![163907o5o43by7j0b6bm5a.jpg]()
再次加热,并重复4-5次
![163739wy73ovvc53bc3cwy.jpg]()
细部拍摄,由此可见电极表面由于热处理产生的小孔(图中黑点)
热处理完毕后,将铂丝缠上。笔者实用的是直径为0.25mm的铂丝,笔者个人认为这个直径比较适合于缠绕,不粗不细。每个电极上缠绕5cm,在笔者的石墨电极上能够缠绕3-4圈。铂丝的一端通过胶带固定在电极上。通过连通性测试,证明电流可从铂丝上流到石墨电极即证明电极合格。
![163900oj5vall5zskr8jva.jpg]()
最终制作好的电极,接在塞子上。塞子上挖槽的目的是为了防止进气过快时电解液溢出。
三、再生模式下的使用与实验
装配好电池,加注电解液后,开始进行充放电实验。笔者使用一块全新9v电池进行充电,再通过万用表测量放电电压和电流数据。
![163747szqfhhn7xno2moih.jpg]()
![163853xrmbemvrdjnrvmcz.jpg]()
![163916q35j5nonqqx23aj3.jpg]()
充电90秒后开始放电,峰值电压和电流数据如下
![163939dlfmewffp5fce5k5.jpg]()
峰值电压(单位:mv)
![163932rteg00ec0e4uhhpm.jpg]()
峰值电流(数据:ma)
![164022ge1oc69k19ts1ko1.png]()
驱动家中闹钟的走时时长纪录
由于家中目前小功率用电器稀缺,暂时还无法进行更多实验。关于本燃料电池的各种应用实验和定量实验将会在以后的文章中一一叙述。













200字以内,仅用于支线交流,主线讨论请采用回复功能。